
領域代表 林(高木)朗子
理化学研究所 脳神経科学研究センター 多階層精神疾患研究チーム

領域代表 林(高木)朗子
理化学研究所 脳神経科学研究センター 多階層精神疾患研究チーム
About
医学の進歩した現代において謎のまま残されている疾患はもはや多くはなく、未だ解明されておらず、謎に包まれている疾患の代表が精神疾患です。うつ症状・不安・妄想・幻聴などの精神症状を呈する精神疾患は、診察室での対話による病歴聴取・症状評価により主観的に診断され、治療に関して言えば、ほとんどの精神疾患には向精神薬による対症治療が行われているが、これらの薬はいずれも偶然発見された薬とその改良版であり、病態機序に立脚して設計された薬とは言い難いのが現状です。
精神疾患の原因解明がこれほどまでに困難なのは、ヒトを対象とした精神疾患研究では、患者サンプルを用いたナノスケールのゲノム解析と、これとは全く対極のマクロスケールであるfMRIなどの脳画像研究が二極化した状態で進行していること、さらに倫理的な制約から脳組織を生検などで直接検証することが不可能だからです【図1】。したがって病態生理や治療標的の中核となりうるマイクロメートルスケール、すなわちシナプス・細胞レベルの病態を解明する手法が極めて限られていました。
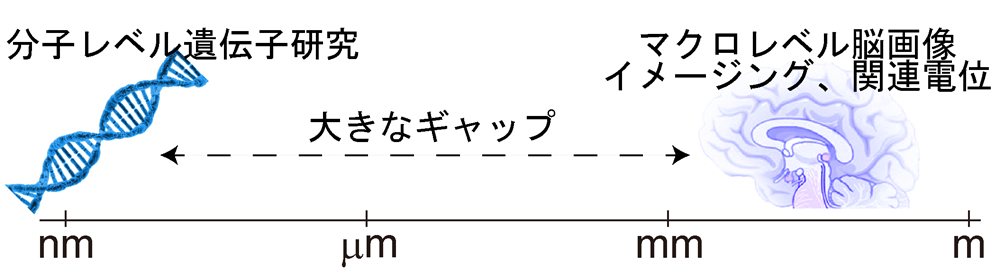
【図1】ヒト脳高次機能研究の現状:
ナノレベルおよびマクロレベルで2極化状態で進行
一方で、ゲノム研究により次々と関連遺伝子が見出されたため、構成的妥当性を満たす精神疾患モデル動物を作出することが可能になり、実際、そのような動物で精神疾患の行動表現型の少なくとも一部が再現できるようになりました。こうした状況の中、我々は、「マイクロエンドフェノタイプ」という仮の説明概念を用いて、こうしたマイクロスケールの精神病態を探求する方向性を示し、双極性障害における視床室傍核病変、統合失調症における神経細胞特異的なレトロトランスポゾン(LINE-1)転移、シナプス体積分布の異常など、マイクロスケールでの精神病態を明らかにしてきました(新学術領域:マイクロ精神病態)。
しかしながら、これら知見はまだ観察レベルの記述的記載の側面が強く、さらにこれらの知見は分子から細胞レベルまで階層に限られています。そのため、これらのナノ・マイクロレベルの階層が、より上位のマクロレベルの階層へ、如何なる相互作用を惹起しながら最終的に行動変容を引き起こすのか不明です。スケールが大きく異なる複数の相互作用が本質的に重要な役割を果たすことを「マルチスケール現象」と物理学では定義しますが、高次脳機能はまさに本質的にマルチスケール現象であり、ナノスケールからマクロスケールまでの各階層が原因であり結果でもある複合相関システムとして高次脳機能を実証しなければ真の理解に到達することは出来ないと考えました。
では、どのように脳機能をマルチスケールな視点で因果関係まで解明出来るのか?随分議論しました。既知の「入力」と「モデル(関数)」から未知の「出力」を求める「順問題」とは異なり、マルチスケールなブラックボックスである高次脳機能の解明は、「入力」としての環境からの刺激と「出力」としての行動変化を計測し「モデル」としての高次脳機能を解く「逆問題」になり、解の存在や一意性が保証されない「不良設定問題」になります。では、不良設定問題をどのように解いたらいいのか?そこで本領域では、不良設定問題は「モデル」に関するデータをもとに、確からしい制約・仮説を設定すれば解けることを利用します(後述:A02班)。そうするために、まず、脳内の分子・細胞・回路レベルの変化を摂動の前後で網羅的に計測し(A01:データ駆動型)、計算機を駆使して膨大な仮説をin silico検証し、その中で最も確からしい仮説や仮説の中心となる因子を絞り込み(A02:アブダクション型、仮説導出型)、それら因子を光遺伝学などを用いて特異的に操作し因果関係を検証するという具合です(A03:仮説検証型)【図2】。
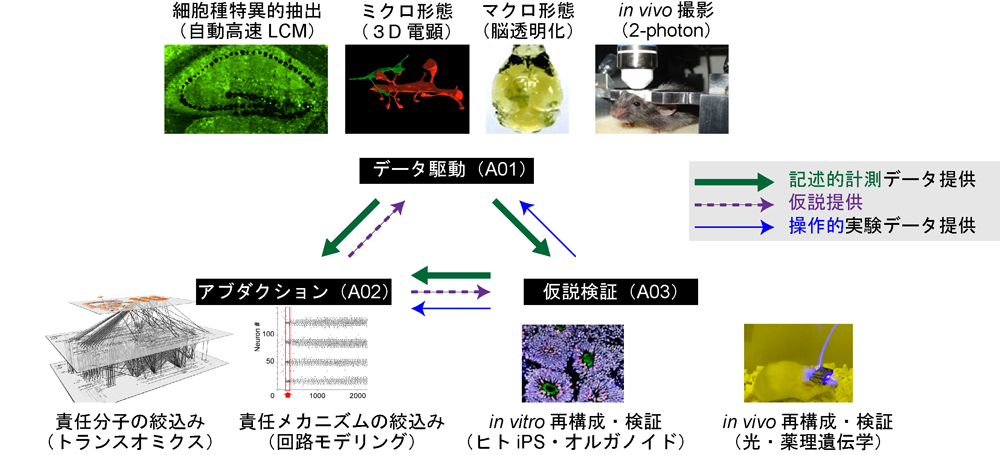
【図2】本申請領域の配置:
データ駆動型アプローチ(A01)は、各階層のデータをマルチスケールに採取・可視化します。このようなデータは、アブダクションアプローチ(A02)を用いて、病態生理の事象を最も適切に説明しうる仮説をin silico導出します。すなわち、実験において観察された知見の集合から出発し、それらの事実についての最も確からしい、ないしは最良の説明へと推論することを目指します。ここで得られた仮説の真偽を検証するために必要となる新たな情報を得るため、仮説検証に力点を置いたアプローチ(A03)、たとえば病因関連分子、シナプス、細胞を光操作などの摂動を加え、その結果生じる現象を分析し、仮説の尤もらしさを検証します。これらのアプローチ分類は各計画班が主に開発を行うアプローチであり、各班は他のアプローチも必要に応じて柔軟に取り入れて、研究を推進します。このような自然科学における因果関係立証のプロセスを明確にすることで、各計画班の主となるアプローチの特長と限界を理解し、異種アプローチ班との有機的連携を強力に推進することが、バーチャル研究所としてのわれわれの新学術領域です。
すなわち、われわれの領域の目的は、前身の「マイクロ病態」領域で見出された知見などを起点として、その上下階層にまたがる構成的理解を試みること、すなわち病因としての最小単位と思われる分子レベルから細胞、神経回路、行動レベルという各階層を、因果律に迫る研究計画デザインで理解することです。このような操作的な実験はモデル動物を用いることが最も有効である一方、モデル動物とヒトでの相同性は常に問題となります。そこで、モデル動物で得られた候補因子をヒト由来iPS細胞や死後脳、ヒト脳画像(fMRI、DTIなど)と比較対照しながら、動物種間横断性を常に念頭に置き、綿密に比較検証していきます。つまり、本申請領域は、階層縦断的に構成的理解を目指すことを縦の糸とし、種間横断的検証(ヒト・マカク属サル・マーモセット・ラット・マウス)が横の糸であり、これらを達成するためのキーワードは「最先端計測」「in silicoモデリング」「光操作」などの技術基盤です【図3】。このように構成的に脳機能を理解することは、精神疾患で障害される精神機能の物質的基盤、とりわけ、ヒト研究単独では決してなしえない必須の基礎知見となりうるとともに、このような知見を基に、動物のみでは研究の難しい高次脳機能を理解することにもつながることが期待されます。
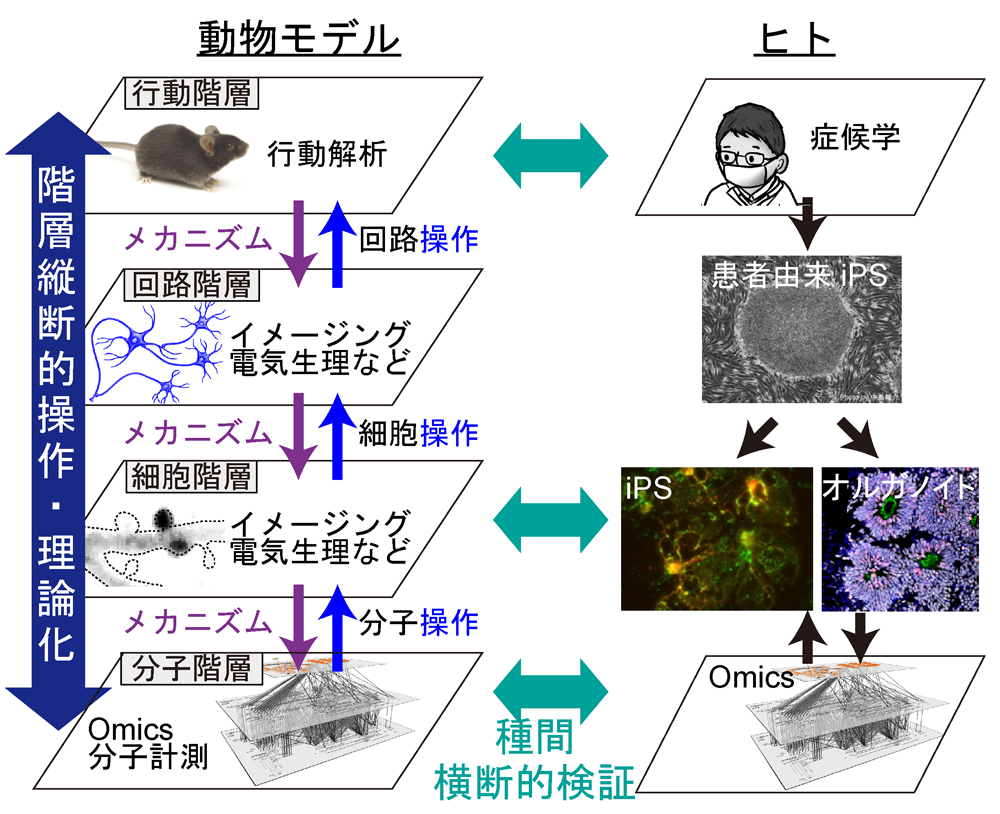
【図3】本領域の骨子:
下位階層へメカニズム探索とともに、操作的手法を用いて上位階層への効果を検証していきます。回路モデリングなどの計算科学や、理論統計を併用することで、因果関係の確からしさについても定量的に検証をします。対応する所見は、ヒトなどのサンプルでも相同性や差異を比較検討することで、われわれが見ている現象が本当にヒト病態と関連があるのか自己批判的に検証を重ねていきます。